


2025年12月6日至10日,第67届美国血液学会(ASH)年会在美国奥兰多隆重举行。会议聚焦临床血液学和基础研究领域的最新进展,推动血液病临床诊疗和临床前研究向着更高目标前进。本期特邀分享陆道培医院王卉主任团队的研究成果,涵盖了16色全光谱流式细胞术、细胞因子加权评分系统和多时间点免疫谱分析模型等前沿技术。这些研究为早期精准诊断、治疗反应评估和临床干预提供了坚实的科学依据,展示了技术创新在血液学领域的重要应用。欢迎广大读者深入交流与讨论。

01、16色全光谱流式细胞术检测T急淋微小残留病
标题Detection of minimal residual disease in t-cell acute lymphoblastic leukemia by 16-color full-spectrum flow cytometry
中文标题:采用16色全谱流式细胞术检测T细胞急性淋巴细胞白血病的微小残留病(MRD)
第一作者:王卉
通讯作者:王卉
研究背景
流式细胞术检测急性T淋巴细胞白血病(T-ALL)的微小残留病(MRD),存在四个主要制约因素:①TdT、CD99等高覆盖率的早期标志物丢失率高,②容易获得成熟标志;③成熟淋巴细胞的免疫表型多样性,尤其是CD4+/CD8+或者CD4-/CD8-T细胞的干扰;④CD7-嵌合抗原受体修饰的T细胞(CAR-T)疗法的应用增加检测难度。为此,我们采用全光谱流式细胞术设计了一个16色方案,试图最大程度解决这些问题。
研究方法
2024年2月28日到2025年5月29日,在河北燕达陆道培医院诊治的T-ALL患者中,使用全光谱流式细胞术进行MRD检测,1025例患者完成1570次检测,男:女为768:257,中位年龄16岁(1-68)。检测方案为CD99 FITC/cCD3 PE/CD3 BV785/CD48 PECy7/CD4 APC Cy7/CD5 APC R700/CD2 BV605/CD7 APC/CD16 efluor 450/CD56 BV711/TdT BV421/CD45 V500 /CD34 PerCP Cy5.5 /CD94 BV650 /CD8a BV570/TCRγδ BV480。总计612人有可以检测的基因。选择完全缓解和MRD阳性各10例进行传统方案和全光谱方案的相关性测试。采用kaluza2.3.0软件进行数据分析。采用SPSS17.0进行统计学分析。采用Fisher的确切概率法进行率的比较。以P<0.05为差异有统计学意义。
研究结果
1、全光谱流式和传统流式两组相关性好,R2=0.9945。
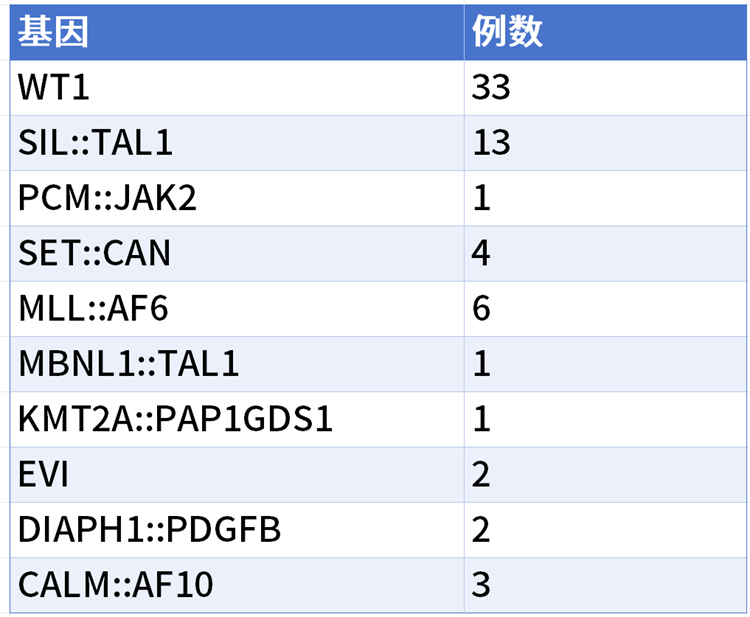
2、1570次检测中,阳性标本为来自103人的155次检测。阳性患者中,男女比79:24,中位年龄21岁(4-68岁)。肿瘤负荷中位数1.66%(0.002-94.15%)。MRD阳性组68人有可以检测的融合基因或者原癌基因(表1),重复检测患者以肿瘤负荷高的计算。
表1 68例有可以检测的融合基因或者原癌基因的T-ALL MRD阳性患者分布
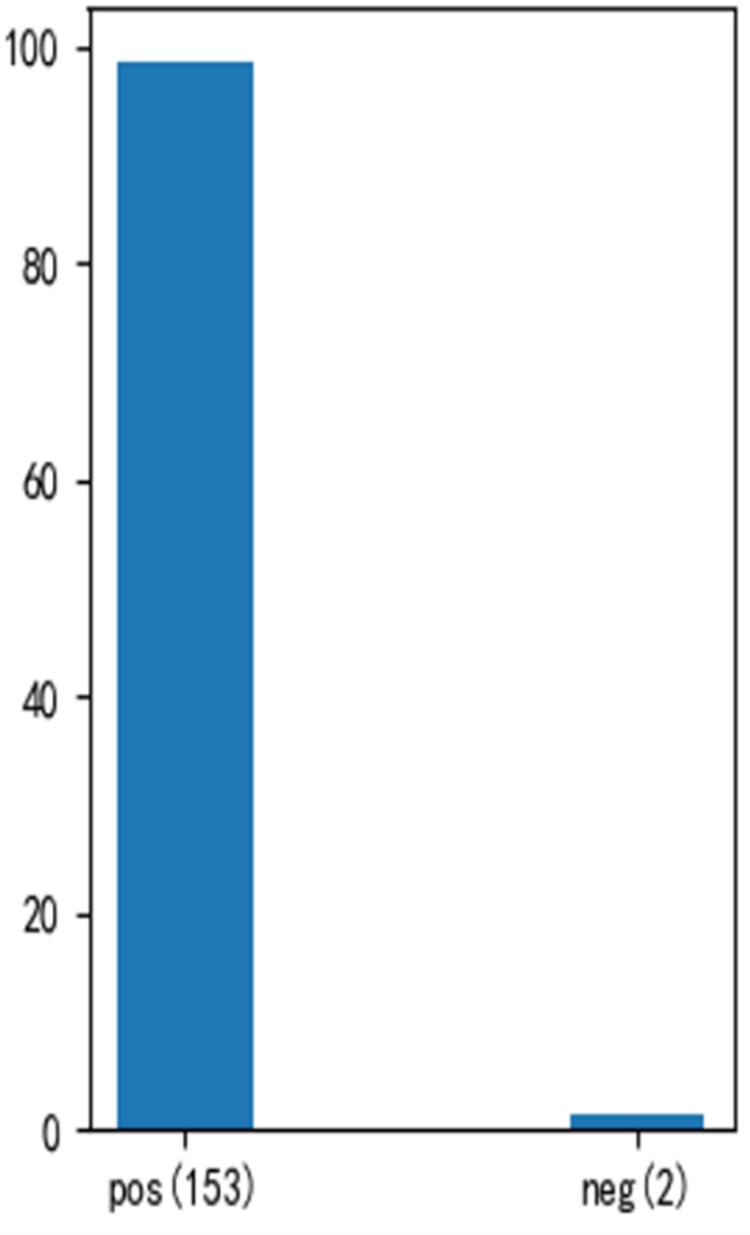
3、CD7 CAR-T后CD7阴性患者52例,MRD阴性组43例,MRD阳性组9例。MRD阳性患者中,cCD3阴性2例,部分阳性4例,CD5阴性2例,CD5dim5例,CD2阴性6例,CD2dim或者部分阳性1例。CD7阴性的52例患者,cCD3、CD2、CD5均阴性率为0(图1)。丢失cCD3的6例患者中2例CD2和CD5均阴性。
4、MRD随访过程中,抗原表达改变情况(图2)。

图2 治疗过程中,部分T-ALL MRD阳性患者抗原表达改变情况
5、遗传学与免疫表型的关系(图2)。CD45dim/CD7bri是最佳设门方法,但是需要排除NK细胞的干扰。MLL::AF6融合基因患者的MRD最容易识别,因为100%表达CD7briCD99briCD48-CD56-CD34+,其次为EVI1遗传学异常病例,100%表达CD7briCD99briCD48+CD56-CD34+,CALM::AF10融合基因患者100%表达CD7briCD99briCD48-CD34+, 但是 67% (2/3) 伴有CD56阳性。PCM1::JAK2基因和某些WT1高表达患者的MRD检测可能具有挑战性(图3)。
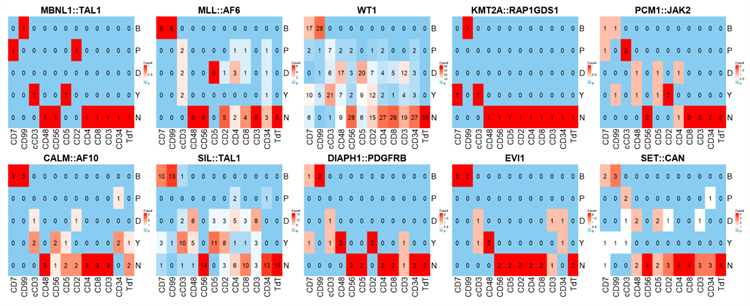
图3 遗传学与免疫表型的相关性分析
研究结论
全光谱流式细胞术的T-ALL MRD检测方案可以同时做4个以上泛系标志,理论上满足98.51%的CAR-T之后MRD检测的设门需要,是一种最有希望的MRD检测方法。遗传学与免疫表型有一定相关性,不同基因型得益于不同的标志物,而全光谱流式同时做更多标志物组合,可以最大限度覆盖各种遗传学亚型的常见异常。
02、动态免疫细胞亚群与细胞因子分析可早期鉴别allo-HSCT后急性胃肠道GVHD与病毒性腹泻
标题:A Multi-Timepoint Immune Profiling Model for Differentiating GVHD- and Infection-Associated Diarrhea Following Allo-HSCT
中文标题:基于多时间点免疫谱分析模型区分同种异体造血干细胞移植后GVHD与感染相关腹泻
第一作者:陈曼
通讯作者:王卉

研究背景
异基因造血干细胞移植(allo-HSCT)是治疗高危血液系统恶性肿瘤以及部分非恶性和先天性疾病的有效根治性手段。尽管近年来移植技术不断进步,移植后非复发性死亡率(NRM)仍然较高。移植后腹泻(post-HSCT diarrhea)发生率可高达40%~91%,是最常见的移植相关并发症之一。移植早期腹泻的病因复杂多样,包括感染、化疗相关黏膜炎、药物毒性及急性移植物抗宿主病(aGVHD)等。其中,胃肠道GVHD(GI-GVHD)和病毒感染是allo-HSCT受者最常见的两大原因。由于aGVHD与感染所致腹泻在临床表现上高度相似,但治疗策略却完全不同(aGVHD需加强免疫抑制,而感染则需抗病毒治疗并减少免疫抑制),因此早期准确鉴别病因对优化治疗方案至关重要。
研究目的
本研究旨在通过动态监测移植后淋巴细胞亚群及细胞因子水平,构建基于免疫特征的预测模型。
研究方法
本研究为回顾性研究,纳入2021年4月至2024年12月在北京陆道培医院接受allo-HSCT且出现腹泻的58例患者。所有患者均完成肠镜检查及肠黏膜活检。病理检查共确诊GI-aGVHD 34例,病毒性肠炎24例(见下图)。所有患者均纳入标准化移植后免疫监测流程,并于腹泻发生前7天内(±3天)完成淋巴细胞亚群及细胞因子检测。排除标准包括:缺乏腹泻前免疫数据、肠镜检查禁忌或拒绝接受内镜检查。随访资料通过电话随访及病历系统获取,生存状态截止至2025年5月31日。统计学分析使用R软件(版本4.4.3)完成。单时间点(腹泻前)及多时间点(腹泻前、第4周和第5周)模型的关键预测因子通过LASSO回归和Logistic回归筛选,并在列线图、校准曲线及决策曲线分析中进行了验证。研究方案经陆道培医学集团伦理委员会批准(编号:DPEC-M-202108),所有研究对象均签署知情同意书。
研究结果
基线资料与临床特征
在58例造血干细胞移植后发生腹泻的患者中,34例确诊为胃肠道GVHD(GI-GVHD,其中15例死亡),24例为病毒性肠炎(8 例死亡)。全队列共32例男性、26例女性,中位年龄33岁(四分位距,16–49 岁)。基础疾病包括再生障碍性贫血7例、AML 31例、ALL 12例、MDS 8例。GI-GVHD的病理分级分别为I级5例、II级10例、III级14例、IV级5例;感染性肠炎病原包括 CMV 8 例、EBV 9 例、CMV+EBV共感染5例、HHV-6 1例、腺病毒1例。两组在移植前病程、腹泻发生时间、腹泻持续时间、有无便血、是否出现高胆红素血症以及其他基线临床特征方面差异均无统计学意义(均P>0.05)。中位随访时间为383天(范围68–1313天),2年总生存率GI-GVHD组为35.2%,病毒性肠炎组为31.8%(P=0.107)。

腹泻发生前1周两组免疫指标的差异分析
在腹泻发生前1周,GI-GVHD患者的Reg3α水平明显高于感染组[2205.74 pg/mL(1174.11–3293.06)vs. 1333.70(1058.83–1634.65),P=0.037],CD3⁺T%[76.13%(47.45–84.27)vs. 50.33%(34.09–63.18),P=0.005]、CD8⁺T%(48.29±19.33% vs. 34.53±19.88%,P=0.011)、初始型CD4⁺/CD4⁺T%[2.28%(0.75–5.73)vs. 1.06%(0.30–2.19),P=0.021]以及Th2/CD4⁺T%(40.18±21.11% vs. 27.77±20.61%,P=0.030)亦均显著升高。与之相反,NK%[17.80%(9.70–40.13)vs. 36.66%(15.46–46.78),P=0.042]及NK细胞计数[48.00(22.25–73.25)vs. 80.00(39.00–164.75)cells/μL,P=0.021]在GI-GVHD组显著降低(图1A)。效应量分析(图1B)显示,两组在CD3⁺T%上存在较大的效应差异,而在CD8⁺T%、NK细胞计数、初始CD4⁺/CD4⁺T%、Reg3α和NK%上存在中等程度差异,与箱线图结果一致。
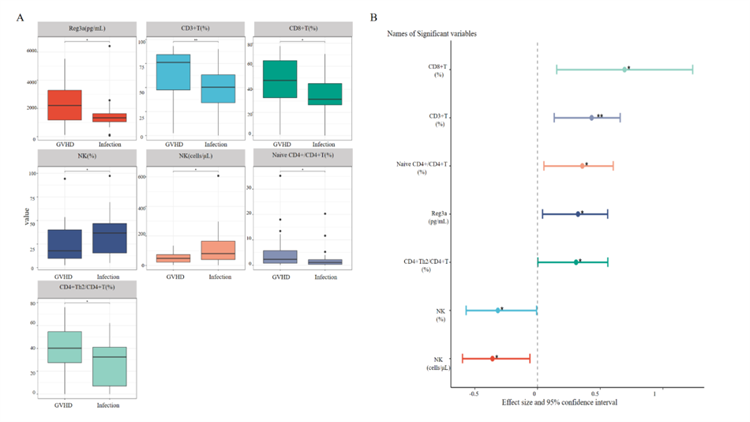
图1. 腹泻发生前差异变量的单因素分析;A. 腹泻发生前 1 周的差异变量;B. 腹泻发生前 1 周差异变量的效应量;注:**表示 P<0.01(差异极显著),表示*P<0.05(差异显著)
在移植后早期免疫重建阶段(移植后第4周和第5周),GVHD与感染患者在相同时间点的多项免疫学指标存在显著差异
第4周时,GI-GVHD患者的TNFR1水平[1064.26(742.06–1685.01)pg/mL vs. 885.56(556.98–1231.06)pg/mL,P=0.048]及初始型CD4⁺/CD4⁺T%[3.66%(1.49–6.09)vs 1.30%(0.20–4.94),P=0.039]均高于病毒性肠炎患者,而NK细胞计数[58.50(27.50–88.00)vs. 113.00(53.25–173.25)cells/μL,P=0.023]及Treg细胞计数[1.00(0–2.50)vs. 2.50(0.75–4.25)cells/μL,P=0.016]显著降低。上述变量呈中等效应量,其中NK细胞计数及初始型CD4⁺/CD4⁺T%的变化趋势与腹泻发生前1周的观察结果一致。至移植后第5周,GVHD患者的GM-CSF水平[0.72(0.54–0.97)vs. 0.44(0.33–0.79)pg/mL,P=0.014]及CD3⁺CD38⁺T细胞计数[46.00(18.25–190.75)vs. 20.50(4.00–74.25)cells/μL,P=0.041]继续高于感染组,而NK细胞计数[43.00(30.00–88.75)vs. 104.00(73.00–155.25)cells/μL,P=0.005]及CD8⁺CD28⁺CD38⁺T/CD8⁺CD28⁺T%[40.23%(16.67–61.75)vs. 71.10%(49.17–87.17),P=0.008]则显著偏低。中等效应量出现在NK细胞计数、CD8⁺CD28⁺CD38⁺T%、GM-CSF及CD3⁺CD38⁺T计数等指标上。值得注意的是,NK细胞计数在腹泻发生前1周、移植后第4周及第5周均在GVHD与感染组之间存在稳定且方向一致的差异,显示其具有持续且中等强度的区分能力(Figure 2)。
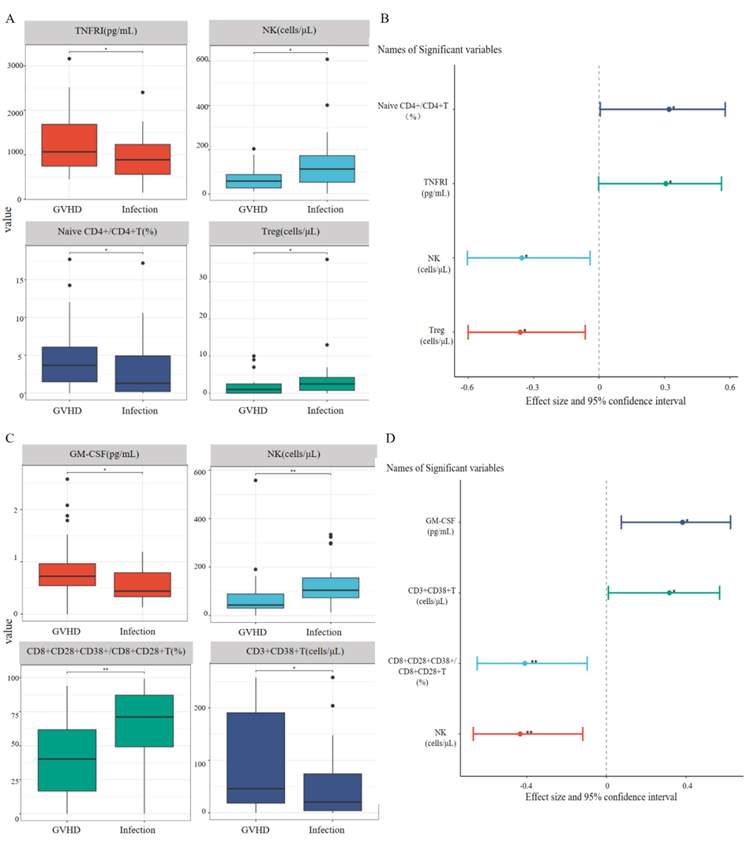
图2. 移植后第 4 周和第 5 周差异变量的单因素分析;A. 移植后第 4 周的差异变量;B. 移植后第 4 周差异变量的效应量;C. 移植后第 5 周的差异变量;D. 移植后第 5 周差异变量的效应量;注:**表示 P<0.01(差异极显著),表示*P<0.05(差异显著)
预测模型构建
4.1 LASSO回归与Logistic回归对多因素预测变量的筛选
LASSO回归共筛选出5个潜在预测指标,包括IL-4、IL-22、CD3⁺T%、NK细胞计数以及CD4⁺CD28⁺/CD4⁺T%(图3)。在初始多因素Logistic回归模型中——logit(P[infection])=0.6162+0.0141×(NK细胞计数)−0.0270×(CD4⁺CD28⁺/CD4⁺T%)——模型整体性能良好(P<0.0001,AUC=0.897,Brier=0.135)。其中,CD4⁺CD28⁺/CD4⁺T%为显著的保护因素(P=0.0043,95% CI:0.950–0.991),每增加1个单位可使感染风险降低约3%,而NK细胞计数呈正相关趋势(P<0.1)。在进一步简化的双变量模型中,上述两项预测因子依然保持稳定的预测效能(χ²=19.98,df=2,P<0.001;C-统计量=0.799,95% CI:0.66–0.98;Brier=0.162)。
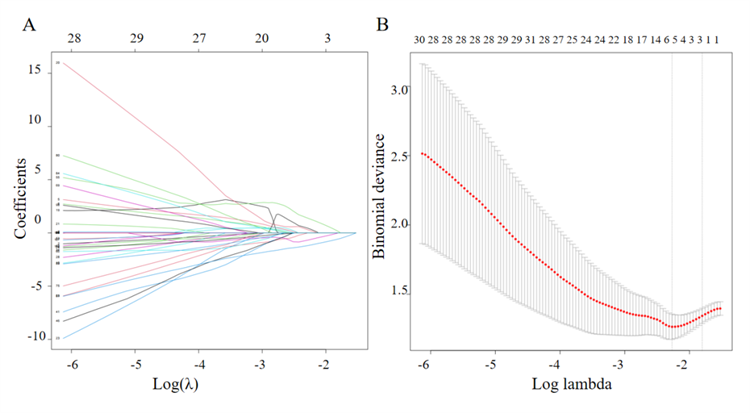
图3. 采用 LASSO 回归筛选提前 1 周预测腹泻发生的变量;A. 系数轮廓图;B. 调优参数选择的交叉验证结果
4.2 单时间点双变量诊断模型的列线图构建与验证
基于双变量模型构建了一个诊断性列线图,通过累加各指标对应的得分用于预测感染/GVHD的风险。该模型表现出良好的校准度(图 4A),并在决策曲线分析(DCA)中显示出较高的临床净获益(图 4C)。校准曲线分析显示模型预测概率与实际观察概率之间具有良好一致性(图 4B)。ROC曲线分析结果显示AUC为0.799,最佳截点为0.408(Youden指数),提示模型具有良好判别能力。在该截点下,模型的敏感度和特异度分别为0.708和0.882,表明其特异度较高而敏感度适中。预测感染风险>40.8%的患者被归类为高风险人群,需要给予临床关注(图 4D)。
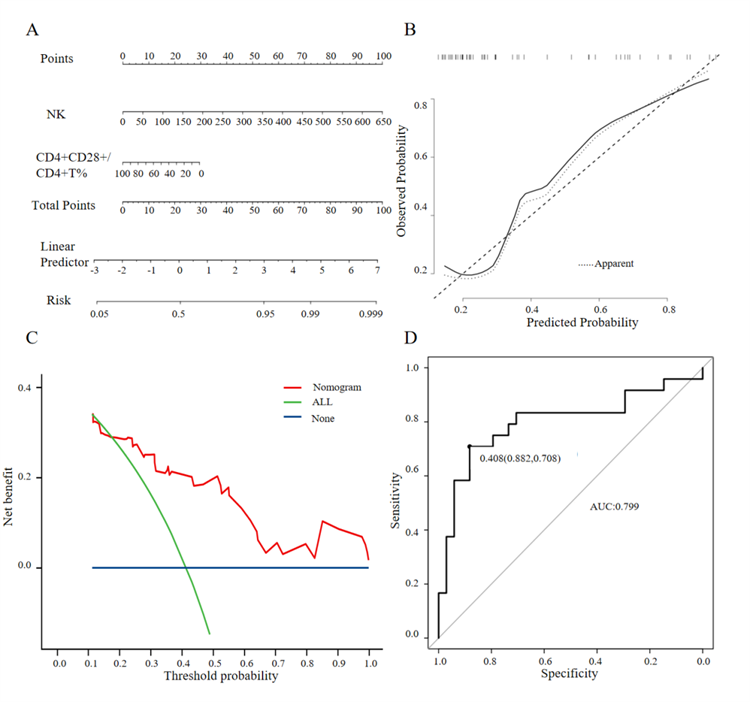
图 4. 提前1周预测腹泻发生的预测模型构建;A. 基于显著预测因子的列线图;B. 列线图的校准曲线;C. 模型的决策曲线分析(DCA);D. 预测模型的受试者工作特征曲线(ROC 曲线)
4.3 构建多时间点预测模型(腹泻发生前1周、第4周及第5周)
针对多时间点预测(腹泻发生前、第4周和第5周),保留了9个关键预测因子,并用于构建加权预测评分(Predicted Score):
\\text{Predicted Score} = 2.6714 - 0.0116 \\times (\\text{CD8⁺T% 腹泻前}) + 0.0049 \\times (\\text{NK 腹泻前}) - 0.0217 \\times (\\text{CD4⁺CD28⁺/CD4⁺T% 腹泻前}) - 0.0256 \\times (\\text{Th2/CD4⁺T% 腹泻前}) - 0.0005 \\times (\\text{TNFR1 第4周}) + 0.0006 \\times (\\text{NK 第4周}) - 1.6570 \\times (\\text{GM-CSF 第5周}) + 0.0038 \\times (\\text{NK 第5周}) + 0.0243 \\times (\\text{CD3⁺CD38⁺T% 第5周})
多因素Logistic回归分析显示,Predicted Score每增加1单位,与感染发生显著相关(OR=5.133,95% CI 2.47–14.71,P<0.001)。ROC曲线分析表明模型区分度优异(AUC=0.908,最佳截点=0.669,敏感性0.875,特异性0.794)。Bootstrap内部验证(1000次重复抽样)显示模型具有良好的校准度与区分度(C统计量=0.884 [0.880–0.889])。校准曲线显示预测概率与实际发生概率高度一致,决策曲线分析则证实了基于该列线图干预的临床净收益(图5)。
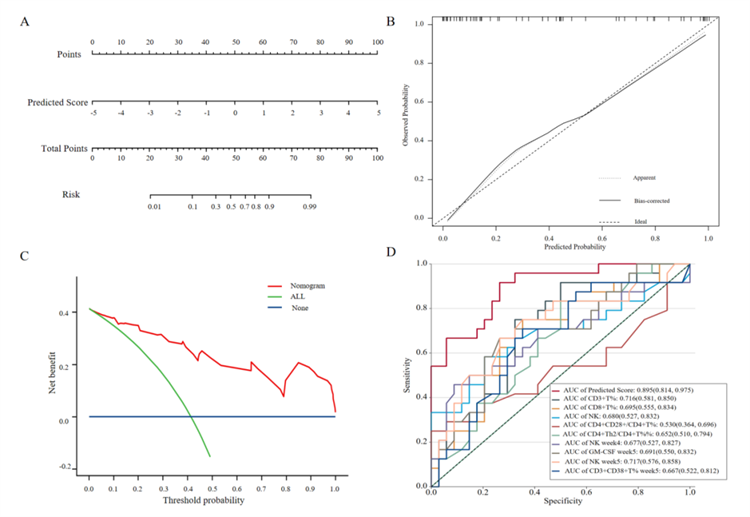
图5. 腹泻发作的纵向预测模型;A. 预后列线图;B. 列线图的校准曲线;C. 模型的决策曲线分析(DCA);D. 模型与各单个时间点预测因子的ROC曲线
研究结论
多时间点动态免疫监测可实现GI-GVHD与病毒性肠炎的早期、准确鉴别,为allo-HSCT后精准免疫监测及及时干预提供了有效工具。
03、评估CD19 CAR-T治疗后免疫状态权重的细胞因子评分系统的建立与验证
标题:Development and validation of a weighted cytokine scoring system for immune status Assessment Following CD19 CAR-T Therapy
中文标题:CD19 CAR-T疗法后免疫状态评估的加权细胞因子评分系统的开发与验证
第一作者:王东出
通讯作者:王卉
背景和目的
本研究建立并验证了一种新型免疫状态评估系统,通过多细胞因子谱分析技术客观评估CD19 CAR-T疗法后的免疫反应,并助力早期识别细胞因子释放综合征(CRS)。该系统通过量化多种细胞因子的作用并提出公式化算法,为简化、科学严谨且快速评估海量数据提供了有效工具。
方法
本研究样本来自2020年3月起在陆道培医院接受CD19 CAR-T疗法治疗的111例难治性/复发性B细胞急性淋巴细胞白血病(B-ALL)患者。研究队列包含用于开发细胞因子评分系统的训练集(n=34)和用于评估临床一致性验证集(n=77)。训练集在六个时间点(CAR-T治疗前(第0天)及治疗后第4、7、14、21、28天)对24种细胞因子(IFN-γ、IL-1β、IL-2、IL-6、IL-10、IL-12p70、TNFα、TNFβ、IL-4、IL-5、IL-8、IL-17A、IL-17F、IL-22、IL-2RA、MCP-1、GM-CSF、IL-15、颗粒酶B、REG3a、ST-2、TNFRI、Elafin和MIP-1α)进行连续检测。验证集则在第0天和第7天进行细胞因子谱分析。
结果
研究发现,治疗后7-10天细胞因子水平达到峰值,随后随着CAR-T细胞与肿瘤细胞相互作用减弱、肿瘤清除进程推进,细胞因子浓度逐渐下降。这一下降趋势与CAR-T细胞、CD3+和CD8+T细胞群体增殖放缓同步发生,到第30天左右,细胞因子浓度已回落至接近基线水平。
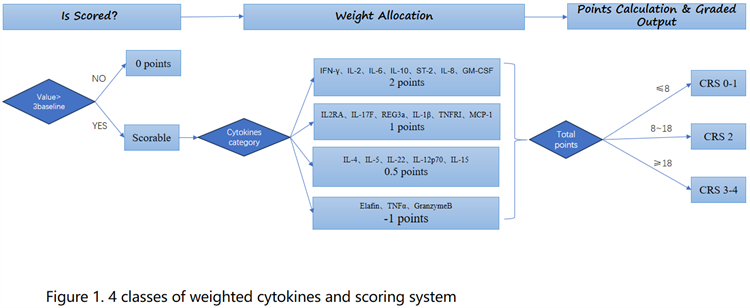
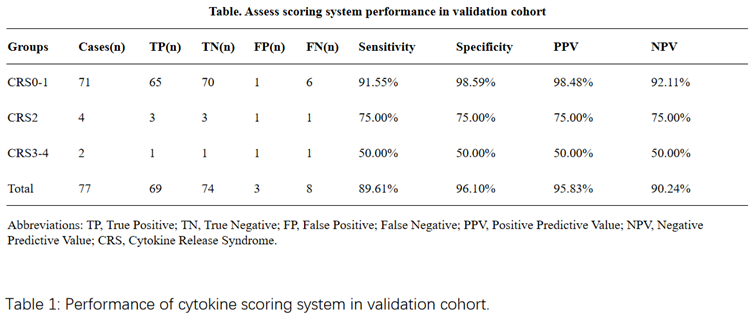
为便于临床应用,我们开发了一套细胞因子评分系统用于评估免疫状态(图1)。24种因子根据其对细胞因子释放综合征(CRS)预测的贡献度分为四个权重等级:I类细胞因子(IFN-γ、IL-2、IL-6、IL-10、ST-2、IL-8、GM-CSF)权重为2.0;II类(IL-2RA、IL-17F、REG3a、IL-1β、MCP-1、TNFRI)权重为1.0;III类(IL-4、IL-5、IL-22、IL-15、IL-12p70)权重为0.5;IV类(Elafin、TNFα、Granzyme B)权重为-1.0。当某细胞因子的峰值超过阈值的三倍时,该因子会被赋予权重分。各细胞因子的得分相加得出总分。根据靶向治疗结果,免疫状态评分≤8分的归类为CRS 0-1级;评分>8分且<18分的归类为CRS 2级;评分≥18分的归类为CRS 3-4级。临床验证显示系统总体灵敏度为89.61%,特异性为96%,阳性预测值(PPV)为95.83%,阴性预测值(NPV)为90%。值得注意的是,在区分0-1级CRS(门诊可管理)与≥2级CRS(需按美国肾脏病学会(ASTCT)标准住院治疗)时,该系统表现更优:灵敏度达91.55%,特异性99%,阳性预测值98.48%,阴性预测值92%,充分证明其在指导关键临床决策中的实用价值(表1)。
结论
该标准化系统为免疫监测和早期干预提供了客观高效的工具,对细胞免疫治疗的临床决策支持具有重要价值。
