

1月6日,陆道培检验医学团队2020年第1篇SCI论文在线发表于国际学术期刊CancerGeneTherapy,报道了AML中t(12;22)(p13;q12)染色体易位的关键致病机制。
t(12;22)(p13;q12)染色体易位是AML中少见的染色体易位。既往研究报道该易位导致MN1基因和ETV6基因分别断裂,并错误拼接形成MN1-ETV6和ETV6-MN1融合基因,这些患者多化疗难治,预后不佳。但文献报道中约半数有该易位的患者虽然FISH检测MN1断裂阳性,但并不能找到MN1-ETV6或ETV6-MN1融合基因的证据。甚至在融合阳性的病例中,MN1-ETV6还是ETV6-MN1起到了主要的致病作用,文献报道并不一致。该易位导致AML发生的确切机制尚未明确揭示。

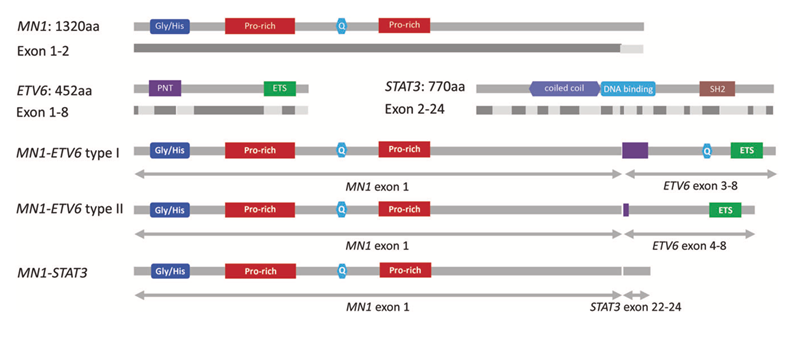
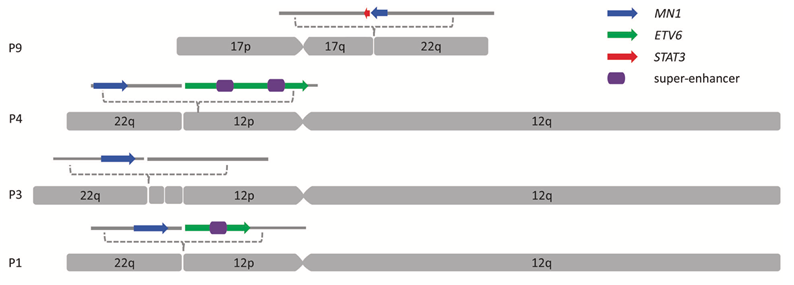
在本研究中,陆道培细胞遗传和分子细胞遗传团队和分子医学团队合作,对8例伴t(12;22)(p13;q12)易位和1例相关的t(12;17;22)(p13;q21;q12)易位患者进行了FISH分析、基因组和基因表达研究。该研究第一次用较大样本量确定了t(12;22)(p13;q12)及相关易位的发生率约0.32%。并且通过基因组和基因表达分析提出该易位的主要发表机制为ETV6因断裂而导致缺陷、MN1因易位到ETV6的增强子附近而被增强表达。在形成或不行成MN1-ETV6融合的患者中,该易位致病的主要机制都是MN1过表达导致的异常活化。同时该研究在另1例t(12;17;22)(p13;q21;q12)易位的病人中鉴定了一例新的MN1-STAT3融合,对MN1-STAT3和MN1-ETV6融合的结构分析进一步证明了MN1功能活化是该组疾病的关键致病机制。
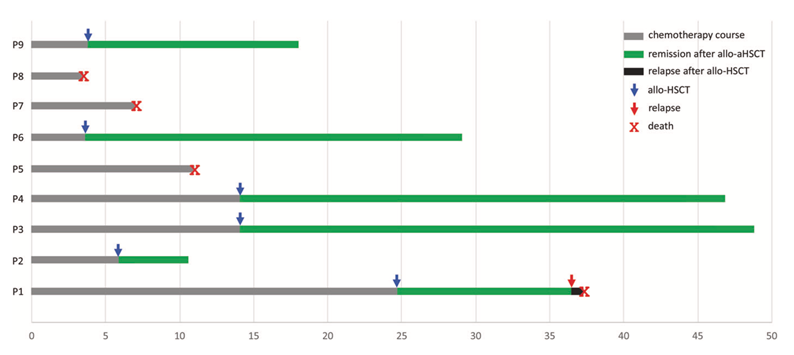
既往报道t(12;22)(p13;q12)易位的AML患者多化疗难治。本研究中的3例仅化疗治疗的患者都原发难治或很快复发,未获得长期生存。而5例诱导化疗后较早行造血干细胞移植的患者都获得了持续缓解和长期生存。但其中一例多次复发后再移植的患者仍发生了复发。这些资料显示,对于该组患者应在化疗控制病情后尽早进行造血干细胞移植治疗,以获得更好的治疗效果。
该研究对部分产生融合转录本的t(12;22)(p13;q12)易位的致病机制提出了新见解。虽然t(12;22)(p13;q12)易位和MN1-ETV6融合少见,但MN1基因过表达是AML中常见的异常。本研究发现在t(12;22)(p13;q12)易位的AML中,MN1过表达与ETV6缺陷及增强子易位协同作用是导致肿瘤发生的关键。这对进一步研究其他伴MN1过表达的AML中其协同作用的基因异常的研究也有很好的启示作用。
陆道培医院细胞遗传和分子细胞遗传室王彤主任是论文的第一作者。
王彤


陆道培血液病研究院副院长、陆道培医院病理和检验医学科主任刘红星是该论文的通讯作者。
