


2025年12月6~9日,第67届美国血液学会(ASH)年会在美国奥兰多盛大举行。作为全球血液学领域规模最大、学术影响力最强、内容最全面的国际盛会之一,每年都会吸引来自世界各地的数万名专家学者,共同分享血液学领域的最新进展与突破性研究成果。在本次大会上,陆道培医院刘德琰主任团队的一项研究入选壁报展示,探讨了异基因造血干细胞移植对SET-CAN融合基因阳性血液肿瘤患者预后的改善。本文特邀第一作者刘肖梅医生对此进行介绍与分享。
标题:异基因造血干细胞移植对SET-CAN融合基因阳性血液肿瘤患者预后的改善
英文标题:Long-Term Outcomes of allogeneic hematopoietic stem cell transplantation (allo-HSCT) in SET::CAN-Positive Hematological Malignancies: A 12-Year Single-Center Study of 36 Patients
研究背景
SET::CAN(又名SET::NUP214)融合基因是一种罕见的染色体异常,最常见于T-ALL患者,阳性率约为4%–6%。该融合常与糖皮质激素及化疗耐药相关,导致传统治疗效果不佳,化疗患者的中位总生存期(OS)约10–22个月左右。既往研究显示,异基因造血干细胞移植(allo-HSCT)可显著改善SET::CAN阳性患者的预后,但相关文献多为病例报告或样本量很小,本研究拟基于本中心12年来所积累的allo-HSCT治疗SET::CAN阳性患者数据以评估其长期随访疗效与生存结局,为该侵袭性强且罕见的血液恶性肿瘤治疗策略提供更有力的数据支持。
研究方法
本研究回顾性分析了36例于2012年10月至2024年8月在河北燕达陆道培医院和北京陆道培医院经PCR扩增法筛查CET::CAN阳性,并通过RT-gPCR进行定量检测阳性的血液病患者恶性血液病患者,系统性治疗后均接受allo-HSCT。随访:所有患者在移植后均进行长期随访,截止日期:2025-1-1。
研究结果
01、基本资料
36例患者中,男性24例,女12例,中位年龄28(12-52)岁。T-ALL占比最高18 (50%),其次是MPAL 9 (25%)、B/T-LBL 5(13.9%)、AML 4(11.1%)。首次移植32(88.9%)人,二次移植4人。初诊时伴有复杂染色体核型7(19.4%)人,基因突变发生率22(61.1%),最常见突变基因为PHF6 (9, 25%)、NOTCH1(8, 22.2%)、NRAS(6, 16.7%)。29(80.6%)例患者移植前CR,化疗至CR中位疗程数目为2(1-7)疗程,7(19.4%)例为NR/PR接受挽救性移植。移植类型上以ATG/G-CSF based haplo-HSCT 为主占27 (75%),其次为MSD-HSCT 5(14%),MUD-HSCT 4 (11%)。72%(26/36)以TBI-based预处理,25%(9/36)以BU-based预处理。预防GVHD方案采用CSA/FK506联合MMF、sMTX方案。输注MNC计数中位数为8.24(6.2-9.48)×10^8/kg,CD34计数中位数为4.38(1.97-9.04)×10^6/kg。中性粒细胞中位植活时间15天(10-20天),血小板中位植活时间14天(7-34天)。Day 100 III-IV度aGVHD累积发生率为16.67%(95% CI 8.03-34.60),中-重度 cGVHD累积发生率为14.49%(95% CI 6.42-32.70)。Day 180CMV血症累积发生率为33.33%(95% CI 21.0-52.91),Day 180 EBV血症累积发生率为16.67%(95% CI 8.03-3.60)。
02、预后分析
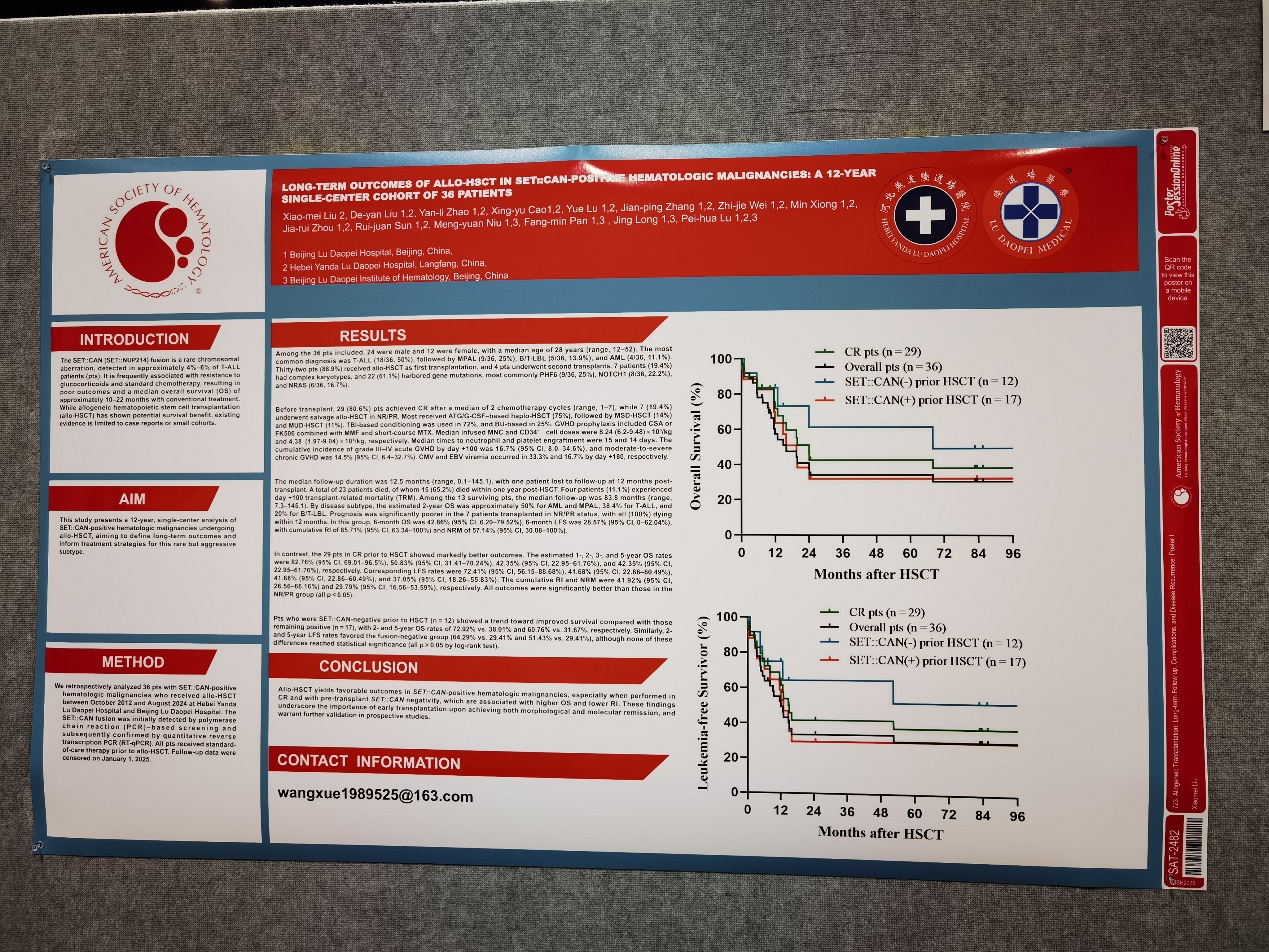
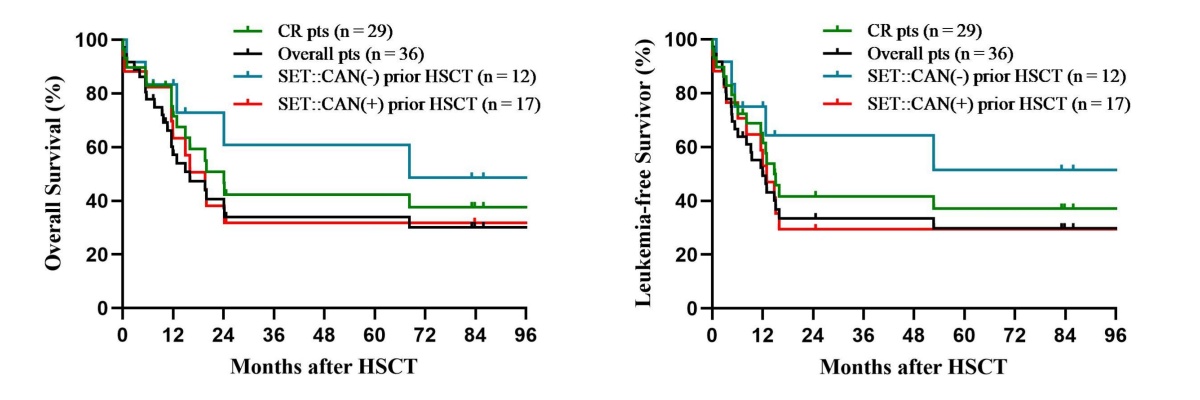
截止2025年1月,中位随访时间为12.5(0.1-145.1)月,其中1人移植12月后正常出院后失访。最终累计23人死亡,15/23(65.2%)均发生在移植后1年内。4/36(11.1%)人发生Day100 TRM。剩余13名存活患者中位随访时间83.8(7.3-145.1)月。从诊断上看,2-year OS AML和MPAL在50%左右,略高于T-ALL(38.4%),B/T-LBL最差仅20%左右。根据移植前骨髓状态,7名NR/PR患者预后很差,全部(100%)在移植后12个月内死亡,6-month OS 仅仅为42.86%(95% CI 6.20-79.52),6-month LFS 仅仅为28.57%(95% CI 0-62.04),累计RI为85.71%(95% CI 63.34-100)、NRM为57.14%(95% CI 30.08-100)。
29名移植前CR患者预后:1-year OS、2-year OS、3-year OS、5-year OS分别为82.76%(95% CI 69.01-96.5),50.83%(95% CI 31.41-70.24),42.35%(95% CI 22.95-61.76),42.35%(95% CI 22.95-61.76)。1-year LFS、2-year LFS、3-year LFS、5-year LFS分别为72.41%(95% CI 56.15-88.68),41.68%(95% CI 22.86-60.49),41.68%(95% CI 22.86-60.49),37.05%(95% CI 18.26-55.83)。累计RI为41.92%(95% CI 26.56-66.16),累积NRM为29.79%(95% CI 16.56-53.59)。均显著优于NR.PR患者(p均小于0.05)。移植前SET::CAN融合基因阴性组(n=12)较阳性组(n=17)2-year OS与5-year OS均有明显增加趋势(72.92% vs. 38.01%; 60.76% vs. 31.67%),2-year LFS与5-year LFS趋势也一致(64.29% vs. 29.41%; 51.43% vs. 29.41%),尽管long-rank统计均暂无无统计学意义(P>0.05)。
研究结论
SET::CAN融合基因阳性的恶性血液肿瘤患者整体预后差,其中B/T-LBL患者即便进行移植预后仍最差,需要更大样本进一步研究。AML、MPAL的预后可能高于T-ALL。移植前CR或达到分子缓解的患者可能在HSCT后提高OS、LFS,但患者移植后2年内仍需进行维持治疗预防复发,长期随访评估预后。
